

Química de la cocina
Utilice su cocina como un laboratorio para aprender acerca de la química de utilizar productos químicos cotidianos.
MIRA EL TRAILER
ACERCA DEL CURSO
El curso de Química de la cocina está diseñado para explorar algunos de los principios de la química. Se le anima a llevar a cabo sus propios experimentos con materiales que se encuentran a menudo en el hogar. Si no se pueden obtener a partir de la mayoría de los supermercados, farmacias o ferreterías.
En el camino que va a utilizar el té de frutas para identificar los ácidos y álcalis, investigar los productos químicos que aceleran las reacciones y experimentar con las reacciones de transferencia de electrones. Esto debe darle una idea de el mundo de las moléculas y una idea de algunas de las reacciones.También debe introducir algunos métodos para separar los productos químicos, para averiguar lo que están presentes en una mezcla y maneras de cambiar los productos químicos de una forma a otra de productos químicos.
Está dirigido a una amplia gama de edades. Los niños menores de 13 años de edad no son capaces de inscribirse en el curso, pero un adulto es bienvenido a firmar en su nombre y supervisión de un adulto se recomienda para los niños pequeños que realizan los experimentos.
EXPLORACIÓN DEL MUNDO MOLECULAR
Consejos de salud y seguridad
Ver50 comentarios
Todo lo que hacemos tiene un elemento de peligro y riesgo. Por lo general, minimizar estas pensando en lo que estamos haciendo y tomando precauciones. En la cocina podemos usar un delantal para proteger la ropa; en el jardín, guantes para protegerse las manos; y cuando la perforación y martillando, protección para los ojos. Hacer experimentos no es una excepción.
Aunque los productos que estamos utilizando son fácilmente disponibles de ninguna manera implica que son seguros en todas las situaciones.Nosotros vamos a usar productos que pueden manchar y algunos que puede desteñir. En todos los casos, es una buena idea considerar exactamente cómo se están haciendo la prueba y use el equipo de protección personal adecuado. Eso es lo que se puede hacer en cualquier laboratorio de química. De hecho, se formalizó con una evaluación de riesgos por escrito y otros documentos.
Su equipo de protección podría consistir en un delantal y un poco de protección para los ojos. En algunas situaciones es posible que desee utilizar guantes también. Guantes de goma para lavar los platos son una excelente opción.
Por lo general hay una prohibición general de comer y beber en un laboratorio de química, pero aquí estamos utilizando la cocina! Por lo que es probablemente la mejor manera de seguir estas reglas al hacer experimentos.
- Nunca pruebe las mezclas de productos químicos que se han hecho
- Siempre siga las instrucciones cuidadosamente
- Siempre tener en cuenta todas las instrucciones en los envases
- Siempre lávese bien las manos después de hacer un experimento
Sin duda habrá algunos niños que ayudan a salir. Por favor, asegúrese de que los niños son supervisados adecuadamente, especialmente cuando se utilizan las llamas y el agua caliente.
Es una buena idea lavarse bien cualquier utensilio, si los ha utilizado para un experimento, a pesar de que la mayoría de los experimentos no resultan en mezclas nocivas. Sería una buena idea para recoger lavados envases de yogurt, que pueden ser eliminados después de su uso, para su uso como vasos.
Trabajar con seguridad en una cocina, un laboratorio o taller de la química es una cuestión de tomar precauciones sensatas para evitar accidentes.Esperamos que usted tome precauciones y disfrutar de hacer estos experimentos de forma segura.
Tamaño y forma
Todo lo que nos rodea está hecho de átomos. Los átomos son los bloques de construcción más pequeños de moléculas que componen los materiales que nos rodean. Mismos átomos están formados por protones, neutrones y electrones ... pero eso es tema de otro curso.
Elementos, tales como carbono, están hechos de un tipo de átomo, átomos de carbono, que están todos unidos entre sí. En carbono y algunos otros elementos (como el azufre, el fósforo y plomo) los átomos se pueden unir de diferentes maneras. Es por eso que somos capaces de tener tanto el grafito y el diamante, tanto hecha de sólo átomos de carbono.
Cuando diferentes átomos se unen entre sí obtenemos compuestos químicos. Un compuesto único puede estar compuesto por muchas moléculas diferentes todos del mismo tipo, como el agua. También puede estar formado por una enorme red de modo que no somos capaces de decir cuando una molécula se inicia y termina la otra. Un compuesto como sal, lo que ponemos en la comida, es un ejemplo.
Es difícil imaginar lo pequeño algunas moléculas son. Imagine (o mirar) una botella de agua dos litros. Esa botella contiene moléculas alrededor 67,000,000,000,000,000,000,000,000 (sesenta y siete septillion) de agua. Eso es aproximadamente el número de veces que usted podría llenar esa botella de dos litros de agua de todos los océanos del mundo. En esa botella de dos litros que hay alrededor de 1.000.000.000.000.000 (mil billones) las moléculas de agua para cada persona viva.
Si quería contar todas las moléculas de agua en su botella de litro de agua dos y empezar a contar a partir del nacimiento del universo, que fue hace unos 13 mil millones años, usted tendría que contar con unos 150 millones de moléculas cada segundo a contar sesenta y siete septillion moléculas entre el comienzo del universo y ahora.
Estos números son tan grandes que los químicos tienen un número que utilizan para hacer la vida más fácil. Este número se llama un topo. Al igual que "una docena" significa doce y "un bruto": 144 (doce docenas), un mol, significa sobre 6020000000000000000000000 (6,02 × 10 23 ).Podemos contar nada en moles, al igual que podemos contar nada a docenas. Es, sin embargo, poco práctico tener un mol de cualquier cosa que es significativamente más grande que una molécula - tal como un mol de moles. (Este párrafo ha sido editado para mayor claridad.)
A pesar de ser tan pequeño las formas de las moléculas tienen efectos en todo lo que nos rodea. Esto se puede ver por desgarro de un periódico. En una dirección la lágrima es más o menos recto y limpio. Ahora intenta desgarro en ángulo recto a la lágrima limpia. La lágrima será irregular o incluso puede convertir a través de un ángulo recto. Eso es porque las fibras de madera que forman el periódico se peinan hacia fuera en una dirección cuando se hace el papel. Las moléculas que forman las fibras de madera también son largas y delgadas, así que es por eso que las fibras de madera son la forma que son.
Del mismo modo que las moléculas de queratina que van a componer el pelo son largas y delgadas. Estos filamentos de queratina se construyen de cadenas de moléculas de aminoácidos, las mismas moléculas que componen las proteínas. La masa media de una molécula de aminoácido es 0,0000000000000000000002 g. El cabello crece aproximadamente 1,25 cm por mes y es en promedio alrededor de 100 m de diámetro. Una estimación de la densidad del pelo es de 1,35 g / cm
3 . Si asumimos pelo para tener una sección transversal circular podemos resolver que un mechón de pelo se pone 0.0000000000546 g cada segundo. Así que la asombrosa cifra de 266 mil millones aminoácidos se añaden a cada pelo cada segundo.
A pesar de que son tan pequeñas que las moléculas que nos rodean ocupan espacio. En el siguiente video veremos lo que sucede cuando damos las moléculas de energía, de modo que puedan tomar un poco más de espacio. La misma masa de las moléculas está ocupando más espacio, y como consecuencia se hace menos denso.
Experimento 1 - Una exploración de la densidad
En este vídeo podemos ver la evidencia experimental de que el agua caliente sube. Un contenedor de agua caliente se coloca sobre un recipiente similar de agua fría y los dos se dejó mezclar, a continuación, el mismo procedimiento se lleva a cabo con agua fría, pero por encima de caliente.
Experimento 2 - levantamiento de aire caliente
Podemos probar dos versiones diferentes de este para demostrar que el aire caliente sube.
Para la primera versión de este experimento necesitarás:
- Una bolsa de basura delgado
- Una tostadora
- Un poco de cinta
- Cartón para poner alrededor de la tostadora.
Ponga un poco de cartón alrededor de la tostadora para que la bolsa se ajusta alrededor de la cartulina, pero no ser capaz de caer en la tostadora.Cuadro, que es aproximadamente el doble de profundo que el tostador es alto hará agradable Un ajuste exacto, superior abierta.

En el extremo abierto de la bolsa de basura poner dos tiras de cinta adhesiva, una a cada lado. Las tiras deben ser de unos 10 cm de largo.Esto ayuda a mantener la boca de la bolsa hacia abajo. La bolsa de basura debe ser lo más fina posible (para minimizar el peso) y por favor tenga en cuenta que algunos están hechos de plástico que tenderá a contraerse por el calor de la tostadora.
Coloque la bolsa en la caja y en el tostador y cambiar la tostadora en (puede que tenga que dejar un hueco en la caja para poder operar la tostadora). Sostenga la bolsa en el suelo hasta que el que sienta que está desarrollando un alza tirar. Deja ir y usted tiene un globo de aire caliente como en la imagen siguiente.

Para la segunda versión de este experimento necesitarás:
- Un platillo
- Una bolsita de té de la clase que se pliega sobre y se fija con una grapa
- Un fósforo o encendedor
Lo primero a tener el alimento básico de la bolsita de té y deseche el contenido. Ahora debería ser capaz de hacer un tubo de salida del papel.Mantener el tubo en su extremo en el plato. Encienda la parte superior del cilindro en la parte superior. A medida que el papel se quema la de una corriente de aire caliente ascendente se produce. A medida que la llama llegue a la parte inferior de la ceniza restante debe ser arrastrado por la corriente de aire caliente.

¿Qué hay en un nombre?
Hay dos tipos de nombres que damos productos químicos. Uno es un nombre sistemático. De este nombre se puede (en principio) saber exactamente lo que la molécula se parece. Por ejemplo podríamos estar hablando de (RS) -2 - (4 - (2-metil-propil) fenil) propanoico. En este caso, el nombre nos dice todo lo que necesitamos saber acerca de cómo se unen los átomos para hacer esta molécula. Siga esteenlace a una página donde se puede manipular una imagen de la molécula.
Usted se dará cuenta de que esta molécula relativamente simple tiene un nombre bastante complicado. Así que junto con el nombre sistemático a menudo existe el equivalente de un apodo. Esto se conoce como un nombre trivial. Estos nombres triviales hacen moléculas mucho más fácil hablar y escribir sobre pero no tienen tanta información sobre la molécula.El nombre trivial de (RS) -2 - (4 - (2-metilpropil) fenil) propanoico se muestra más arriba, es ibuprofeno. No seríamos capaces de trabajar en lo que la molécula se parecía a partir del nombre trivial, pero podemos partir de los nombres sistemáticos.
Los nombres sistemáticos son un desarrollo reciente y algunos de los productos químicos que usamos fueron descubiertos y nombrados antes de nomenclatura sistemática comenzó a ser utilizado. Algunos de los primeros compuestos se descubrieron incluso antes de que las estructuras de las moléculas se entiende correctamente. Esas estructuras, como los nombres sistemáticos, son una forma de mostrar cómo los átomos están unidos entre sí. A veces es útil para escribir todos los átomos de una molécula utilizando los símbolos que encontramos en la tabla periódica.Usted puede saber que el agua puede escribirse como H 2 O. El subíndice 2 nos dice que hay dos átomos de hidrógeno (H) unidos a un átomo de oxígeno. No utilizamos un subíndice 1 en el oxígeno (O) para demostrar que no es sólo un átomo de oxígeno!
El etanol es el alcohol que encontramos en cervezas, vinos y licores.Contiene dos átomos de carbono y seis átomos de hidrógeno y uno de oxígeno. Podemos escribir su fórmula molecular (utilizando C para representar un átomo de carbono) CH 3 CH 2 OH, o de otra manera estaríamos C 2 H 6 O. La última forma, sin embargo, podría representar un número de diferentes moléculas (tales como CH 3 OCH 3 ) que se conoce comúnmente como el éter.
A menudo, el nombre trivial refleja el origen de la sustancia química en cuestión. Un ejemplo de esto es el ácido salicílico. El nombre sistemático es ácido 2-hidroxibenzoico pero fue aislado de la corteza del sauce, para los que el nombre en latín es salix .
Muchos de estos nombres triviales están todavía en uso, especialmente para los productos químicos muy comunes. Usted puede ser capaz de encontrar ejemplos en su casa.
En representación de las formas de las moléculas
Hay un montón de maneras de representar moléculas y cada uno tiene ventajas y desventajas. Sobre todo, los químicos llaman estructuras planas de moléculas individuales, al igual que la imagen de la cafeína: A menudo, esto puede ser suficiente para un químico capacitado para que puedan resolverse cómo la molécula reaccionaría.
A menudo, esto puede ser suficiente para un químico capacitado para que puedan resolverse cómo la molécula reaccionaría.
 A menudo, esto puede ser suficiente para un químico capacitado para que puedan resolverse cómo la molécula reaccionaría.
A menudo, esto puede ser suficiente para un químico capacitado para que puedan resolverse cómo la molécula reaccionaría.
A veces es mejor que ser capaz de ver la relación tridimensional de los átomos en una molécula. Es relativamente fácil de imaginar esto en el diagrama plano en algo así como la cafeína. En este caso, los átomos se pueden extraer como bolas unidas con palos. Los palillos en el llamado modelo de bolas y palo muestran cómo se unen los átomos junto con los bonos. Una representación de bolas y palo de la cafeína se parece a esto:

Ya no tenemos letras para representar los diferentes átomos por lo que estos colores ahora convertido codificado. Los átomos blancos son hidrógeno (H), que se quedan fuera de la estructura plana para que no se desordenan el diagrama - que ahora son "implícita". Los átomos de grises representan de carbono (C), que también no están dibujados de manera explícita en la estructura plana. Hay un carbono implícita en cada esquina y el final de una línea con nada más en el final. Bolas rojas representan el oxígeno (O) átomos y las azules de nitrógeno (N)
Otra representación es importante cuando hay que ver hasta dónde se extienden los átomos en el espacio. Dos de las formas de lidiar con esto son para mostrar la magnitud de la molécula usando puntos en la parte superior del modelo de la bola y el palo, así:

Una alternativa es el llamado modelo de llenado de espacio. Esto completa la superficie mostrada por los puntos de manera que el modelo interno es ahora oscurecido y se ve así:

Se puede producir y manipular estos modelos en el equipo e incluso tener una idea de ellas en 3D. El enlace a la cafeína le llevará a una página con un applet que permita la apariencia y el tamaño de la molécula a ser manipulados. Si tienes las gafas en 3D (con lentes de colores por ejemplo, rojo y azul) que usted será capaz de tener una idea de lo que la molécula se ve como en 3D mediante el uso de los controles.
La mejor manera de tener una idea de la naturaleza tridimensional de las moléculas de ti es construir tú mismo. Esto se puede hacer con costosos sistemas de modelado molecular o con malvaviscos y palillos. La ventaja con los conjuntos de modelado es que los ángulos ya están definidos para usted, mientras que usted tendría que saber lo que los ángulos son y calcular bien para construir estructuras realistas con malvaviscos (o pasas o similares).

El agua en tres estados diferentes, sólido, líquido y un gas invisible.© Stephen H. Ashworth
Pasando
Esta semana hemos dado un vistazo rápido en el mundo de las moléculas. Sus formas y tamaños son importantes ya que afectan a las propiedades de las cosas que nos rodean. También hemos visto que las moléculas absorben diferentes cantidades de espacio en función de la cantidad de energía que tienen.
Si calentamos un sólido suficiente que se convertirá en un líquido, si calentamos un poco más se convertirá en un gas. En la próxima entrega vamos a ver en estos tres estados de la materia. También vamos a observar los cambios donde se forman nuevas sustancias químicas. Es importante ser capaz de distinguir entre los dos tipos diferentes de cambio, especialmente en lo que a veces ambos tipos se producen al mismo tiempo.
Para los experimentos en la próxima entrega, necesitará:
- Una vela.
- Fósforos o encendedor para encender la vela.
- Un trozo de metal en frío, como una cuchara.
- Una pequeña cantidad de vinagre.
- Una pequeña cantidad de bicarbonato de sodio (bicarbonato de sodio, carbonato de hidrógeno de sodio)
- Un contenedor. Esto podría ser un vaso o una olla de lavado yogur. (Si el vinagre es un recipiente transparente incoloro será mejor).

La nieve y el hielo que cubre el campo© Stephen H. Ashworth
Estados de la materia
Considere la posibilidad de un pedazo de hielo. El hielo es un sólido y nos dicen que esto es agua en el sólido estado. Si las moléculas de agua en el hielo absorben la energía suficiente (por lo general en la forma de calor) que pueden liberarse del sólido que conduce a la fusión. El hielo se ha convertido en líquido: el líquido de estado.Calentar el agua en estado líquido hasta un poco más y se convertirá en un gas .
Definimos un sólido como algo que mantiene su forma. Un líquido, por otra parte, toma la forma de su envase, pero no llena necesariamente el recipiente. Considere la posibilidad de un vaso medio lleno de agua, el agua toma la forma de la copa, pero la mitad superior no se llena de agua.Un gas es una sustancia que se llevará a la forma de su recipiente y llenarlo por completo. Nos encontramos moléculas del gas a lo largo de su contenedor.
Esto significa que las moléculas que componen un sólido son generalmente muy juntas y no moverse mucho, los que componen un líquido tienen más energía para que puedan moverse libremente, pero tienden a permanecer en contacto unos con otros, mientras que en un gas de la moléculas tienen tanta energía que se pueden mover a lo largo del contenedor y son, en promedio, mucho más separados que las moléculas de un sólido o un líquido.
Si tomamos un sólido (como hielo) y fundirlo, podemos deshacer este proceso y convertirlo de nuevo en hielo, sencillamente. Por otro lado, si tomamos un líquido como la clara de huevo y cocinar a una temperatura lo suficientemente alta que se convertirá en un sólido, pero no podemos cambiarlo de nuevo en un líquido: el carácter de la sustancia ha cambiado por completo. Las moléculas en la clara de huevo se han transformado en moléculas diferentes y somos incapaces de cambiar de nuevo, de una manera sencilla, al líquido original. Este es un ejemplo de un cambio químico, mientras que la fusión del hielo y la congelación es un ejemplo de un cambio físico.
Todo existe en los tres estados de la materia, pero en algunas condiciones la sustancia puede transformarse en un líquido que está en algún lugar entre un líquido y un gas, esto se conoce como un fluido supercrítico.
Las mezclas tienden a ser más complicado - fluidos no newtonianos pueden tener propiedades intermedias entre un sólido y un líquido. Harina de maíz y el agua es un buen ejemplo. Mezclar un poco de agua y harina de maíz juntos y se puede producir una sustancia que fluirá cuando se le deja por su cuenta, pero se romperá cuando un duro golpe.
Nuestros experimentos en esta sección le dará ejemplos de cambios donde hacemos nuevas moléculas (cambios químicos) y aquellos en los que no se hacen nuevas moléculas, pero las sustancias pueden cambiar de forma entre sólidos, líquidos y gas (un cambio físico).

Piense en todos los cambios que se están produciendo como una vela quema.© Stephen H. Ashworth
Experimento 1 - Una vela encendida
Vamos a encender una vela y examinar todos los cambios que están teniendo lugar.
Para este experimento necesitarás
- Una vela
- Fósforos o encendedor para encender la vela
- Un trozo de metal en frío, como una cuchara
Encienda la vela y observar todo lo que sucede. Una vez que la vela se ha estado quemando un poco de tiempo puso una pieza de metal en frío, como una cuchara, en el breve llama. Debes encontrar que la vela se deja algo en la cuchara. Examine cuidadosamente estos depósitos.
Finalmente apagar la vela y rápidamente traer un fósforo encendido hacia la mecha aún cuando todavía está caliente - ¿qué observas?

Una vela encendida© Stephen H. Ashworth
¿Qué has visto?
Usted puede notar que al encender la vela inicialmente que necesita para mantener su fuente de calor (un fósforo o encendedor) cerca de la mecha hasta que parte de la cera se derrite, al igual que el derretimiento del hielo para formar agua. Una vez que la cera se ha derretido comienza a evaporarse y formar un gas. Este es el gas que se quema en realidad en el oxígeno del aire.
A medida que la cera se quema se convierte principalmente en agua (H 2O) y dióxido de carbono (CO 2 ). Si pones un pedazo de metal en la breve llama que podría haber observado otras sustancias. La llama se habría producido el hollín negro que es principalmente de carbono. Esto sucede porque no hay suficiente oxígeno para quemar toda la cera por completo, si lo hubiera, a continuación, se producirían sólo dióxido de carbono y agua. Es la brillante hollín que hace que la llama da hacia fuera la luz. Si se produjeron sólo el dióxido de carbono y agua llamas de las velas sólo darían la luz azul, como las llamas de gas hacen.
Si usted mira muy de cerca, también puede ser capaz de hacer algunas gotas de cera condensada, así como el hollín. Este es el, hasta ahora, la cera sin quemar que se ha condensado en la cuchara fría y se volvió a cera sólida.
Podemos ver que hay muchos cambios diferentes pasando. Cera sólida se convierte en líquido y que a continuación se evapora para convertirse en un gas. La cera gaseosa puede quemar el oxígeno para producir agua, dióxido de carbono, el carbono, el calor y la luz.
Si se sopla la llama y rápidamente traer una cerilla encendida la vela se encenderá de nuevo sin su partido tocar la mecha. Si eres lo suficientemente rápido no habrá suficiente cera gaseoso alrededor de la mecha caliente para encender la vela de nuevo.

Bicarbonato de reaccionar con vinagre© Stephen H. Ashworth
Experimento 2 - Observando más cambios
Vamos a hacer un experimento y tratar de averiguar si un cambio es química o física. ¿Han cambiado las sustancias involucradas, o ellos simplemente cambiar de estado, fundir o hervir por ejemplo.
Para este experimento necesitarás:
- Una pequeña cantidad de vinagre.
- Una pequeña cantidad de bicarbonato de sodio (bicarbonato de sodio, carbonato de hidrógeno de sodio)
- Un contenedor. Esto podría ser un vaso o una olla de lavado yogur. (Si el vinagre es un recipiente transparente incoloro será mejor.)
Bicarbonato de sodio se utiliza como agente de recaudación en la cocina - que ayuda a que la luz de cocción y esponjosa.
Ponga una pequeña cantidad de vinagre en el recipiente. Será suficiente para llenar el recipiente hasta una profundidad de dos a tres centímetros.Añadir un poco de bicarbonato de sodio - aproximadamente la mitad de una cucharadita es suficiente.
¿Qué se observa?

El agua en los tres estados de la materia, sólido (hielo), líquido (agua) y gas (vapor de agua invisible).© Stephen H. Ashworth
Químico o físico?
Estos dos experimentos tienen resultados muy diferentes. ¿Es posible identificar todos los cambios que se están produciendo en cada experimento y para clasificarlas en los cambios físicos y químicos?¿Están todos los cambios fácilmente clasificadas como cambios físicos o químicos?

Estelas de condensación de un avión de alto vuelo -. Física (condensación) y química (combustión) cambios© Stephen H. Ashworth
Pasando
Esta semana hemos visto las diferencias entre los cambios químicos y físicos. Es importante ser capaz de decir cuando nuevas moléculas se han formado más que cuando la materia acaba de cambiar entre diferentes estados.
En cuanto a una vela encendida, vemos que hay dos cambios físicos, como la cera sólida se funde para formar un líquido y luego de que el líquido se calienta hasta convertirse en el gas que se quema. Como el gas se quema las moléculas de cera gaseoso reaccionan con oxígeno y forman principalmente dióxido de carbono y agua.
Al hacer la química de estas propiedades físicas de las sustancias son a menudo tan importante como las propiedades químicas. La pureza de una sustancia a menudo se puede evaluar mediante la medición de un punto de fusión, por ejemplo. Otra propiedad física importante es lo bien que una sustancia se disuelve en otra. Nos veremos en la próxima entrega de cómo la solubilidad se puede utilizar para separar sustancias a partir de mezclas de muy complejas simples.
Para la siguiente serie de experimentos que se necesitan:
- Un frasco transparente limpio o un contenedor con una tapa que cierre bien
- Un poco de agua (o vinagre)
- Algunos de aceite comestible, tal como aceite de maíz, aceite de oliva, aceite de girasol o similar
- Un poco de mostaza, la cebolla o detergente (jabón)
- Arena, café molido usado o alguna otra cosa menuda, de grano que es insoluble en agua
- El azúcar, la sal u otra sustancia que es soluble en agua
- , Colador de té, papel de filtro de café tamiz u otro tamiz adecuado
- Tintura de yodo
- Agua
- Aceite de cocina - el más pálido en el color, mejor
- Dos pequeños recipientes transparentes idénticos
- Color de los alimentos o de la tinta de un rotulador u otro lápiz (no bolígrafo)
- Sal
- El papel secante u otro papel absorbente (aunque toalla de cocina es absorbente que no es adecuado para este experimento, ya que a menudo no es el mismo en todas partes)

El agua no es el único líquido que se puede utilizar para disolver otras sustancias© Stephen H. Ashworth
Solubilidad
Estamos familiarizados con disolución de azúcar en las bebidas calientes o la sal en el agua para cocinar. El proceso de disolución significa que las moléculas en, por ejemplo, los cristales de azúcar, se separan el uno del otro y extendiéndose a través del agua que se han disuelto pulg azúcar (o sal) disuelto en agua se conoce como unasolución . Una solución es, por definición, claro: podemos ver a través de él. Una solución puede ser de color, pero debe ser transparente.
El líquido disolvemos algo se llama en un disolvente y la cosa que se está disuelto se conoce como un soluto . Cuando ponemos el azúcar en el café del café (que es principalmente agua) es nuestro disolvente y el azúcar en el soluto. El agua es un disolvente muy bueno: se puede disolver muchas cosas. Sin embargo, a veces tenemos que disolver las cosas que el agua no se puede. Para ello se utilizan otros disolventes.
Poliestireno, por ejemplo, no se disuelve en agua. En la foto de arriba estoy disolver un trozo de poliestireno. Para ello estoy utilizando un líquido llamado acetona. La acetona se usa en quitaesmalte para ayudar a disolver el esmalte de uñas. A veces es posible disolver el poliestireno con quitaesmalte, pero muchos preparados ahora tienen demasiada agua. En la imagen de arriba acetona pura, en una ferretería, se está utilizando.
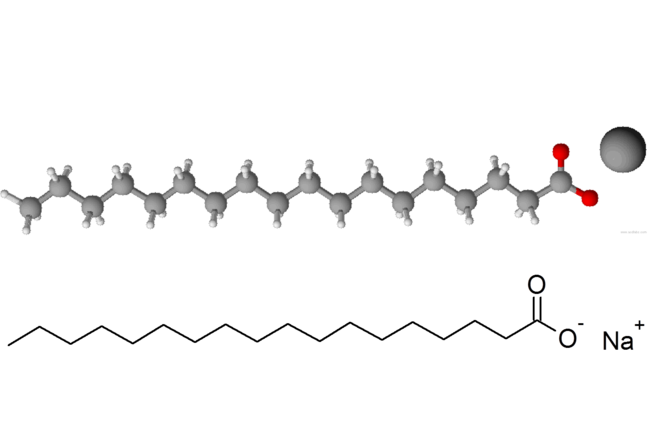
Una molécula típica de tensioactivo, estearato de sodio, que se encuentra en muchos jabones.© Stephen H. Ashworth
Los disolventes y tensioactivos
Si tenemos un líquido que no puede ser visto a través de ella ya no es una solución. Un líquido tal como leche parece blanco debido a una gran cantidad de pequeñas gotas de grasa. Estas gotitas de grasa, la luz no conseguir a través del líquido. Este tipo de líquido se conoce como una emulsión como un líquido (en este caso agua) está rodeando pequeñas gotas de otro líquido. Esta disposición también puede ser familiar en la pintura de emulsión.

Cuando un líquido está rodeando pequeñas piezas de un sólido llamamos a esto una suspensión . A menudo, los pigmentos en las pinturas son pequeñas partículas sólidas y este tipo de pintura pueden ser clasificados como suspensiones. Otra suspensión familiar es la leche de magnesia. El aspecto lechoso de este líquido es el resultado de pequeñas partículas de luz no permite sólida para llegar a través del líquido.
La grasa o aceite no suele mezclar con agua. Si queremos limpiar alguna vajilla que se ha utilizado con grasa o comida grasosa que sería bueno si tuviéramos una manera de utilizar agua en lugar de tener que utilizar un disolvente tal como acetona. Para hacer esto tenemos que hacer pequeñas gotas de grasa y la utilización molécula que son activos en las superficies. Estas olas as act ivo moléculas se conocen comosurfactantes .
Los surfactantes son moléculas que se acumulan en las superficies de las gotas donde la gota de aceite se encuentra con el agua circundante. Parte de la tensioactivo le gusta a disolverse en aceite o grasa y la otra parte le gusta a disolver en agua. De esta manera los tensioactivos mantienen las pequeñas gotas de aceite de unirse a hasta hacer grandes gotas de aceite y, finalmente, la separación del agua para formar una capa aceitosa. Así es como funcionan los detergentes para ayudar a lavar nuestros cuerpos, nuestra ropa y nuestros platos sucios.
El estearato sódico se muestra más arriba es un buen ejemplo. El final del ion estearato (con los dos átomos de oxígeno de color rojo) más cercana a la de iones de sodio positivos tiene una carga negativa, por lo que es muy parecido a cloruro de sodio, la sal común. El cloruro de sodio le gusta a disolver en agua y también lo hace el extremo cargado de la molécula anterior. Por otro lado, el resto del estearato de iones no tiene carga, es mucho más soluble en grasas y grasas. Lo terminamos con son pequeñas gotas de grasa que tienen la "cola" de estas moléculas disueltas en ellos y "cabeza" se pegan fuera de la burbuja, lo que permite que se disuelva en el agua. (Párrafo editado)

Una solución© Stephen H. Ashworth
Experimento 1 - Disolución de aceite en agua
En este experimento vamos a permitir que el aceite para disolver, o al menos formar gotas muy pequeñas, en el agua.
Para este experimento necesitarás:
- Un frasco transparente limpio o un contenedor con una tapa que cierre bien.
- Un poco de agua (o vinagre)
- Un poco de aceite comestible, tal como aceite de maíz, aceite de oliva, aceite de girasol o similar.
- Un poco de mostaza, la cebolla o detergente (jabón) - tensioactivo.
Ponga un poco de agua en el recipiente hasta una profundidad de dos a tres centímetros o menos de la mitad. Añadir aceite al recipiente de modo que se trata de la misma profundidad. Selle el contenedor y agite bien.Deje el recipiente sin molestias por un tiempo. Usted debe ver que el aceite y el agua poco a poco se separan. Pequeñas gotas de aceite se reúnen y forman gotas más grandes, y esas gotas más grandes se unen para unirse al aceite que flota en la superficie del agua. Hacer una estimación de la rapidez con que ocurrió. La velocidad dependerá de lo vigorosamente que sacudió el contenedor - el más vigoroso que el temblor, la más pequeña de las gotitas de aceite que se forman y cuanto más tiempo se necesita para separar.
Ahora abra el frasco y añadir un poco del agente tensioactivo. Ahora agitar el frasco de nuevo, aproximadamente la misma cantidad como lo hacía antes. Esta vez usted debe encontrar que se necesita mucho más tiempo para que el aceite y el agua para separar. Si usted no ha utilizado detergente también se puede utilizar esto como un aderezo para ensaladas.

Arena insoluble puede separarse de la sal soluble por filtración.© Stephen H. Ashworth
Experimento 2 - La separación de sustancias solubles e insolubles
En este experimento usaremos la disolución para separar soluble a partir de los sólidos insolubles.
Para este experimento necesitarás:
- Arena, café molido usado o alguna otra cosa menuda, de grano que es insoluble en agua
- El azúcar, la sal u otra sustancia que es soluble en agua
- , Colador de té, papel de filtro de café tamiz u otro tamiz adecuado
Mezclar un poco de la arena (su sustancia insoluble) con un poco de azúcar o sal (la sustancia soluble). Si tuviera que separar estos por parte, sería una tarea larga y cansada. Podemos, sin embargo, hay que separarlos simplemente añadiendo un poco de agua. La sal o el azúcar se disuelve en agua (un cambio físico) y la arena pueden simplemente ser filtrada utilizando un colador, colador de té o café de filtro apropiado. El azúcar (o sal) pueden ser recuperados por dejar que el agua se evapore.
Este es un método estándar de la separación de las sustancias en la química. El proceso de separación de un sólido insoluble de un líquido se conoce como filtración . A veces es el sólido que es importante, a veces el líquido y, a veces ambos.

El yodo se disuelve en el aceite en vez de agua© Stephen H. Ashworth
Experimento 3 - La separación de sustancias solubles
En este experimento, vamos a ver si el yodo se disuelve mejor en el aceite que en agua.
Para este experimento necesitarás:
- Tintura de yodo
- Agua
- Aceite de cocina - el más pálido en el color, mejor
- Dos pequeños recipientes transparentes idénticos
Añadir unas gotas de tintura de yodo para un poco de agua. El yodo se disuelve en agua para formar un líquido de color amarillo pálido. Vierta un poco de este líquido (a una profundidad de 2-3 cm) en cada uno de los frascos idénticos. Para una de las porciones de añadir aproximadamente la misma cantidad de aceite de cocina. Agitar esta mezcla suavemente de modo que el aceite y la mezcla de agua. Luego dejar reposar hasta que el agua y el aceite se han separado. Comparar el color del agua (la capa inferior) y la otra porción de yodo y agua. ¿Qué se observa?
Una extensión de este método es una técnica conocida comocromatografía . Vamos a tratar de que en el próximo experimento.
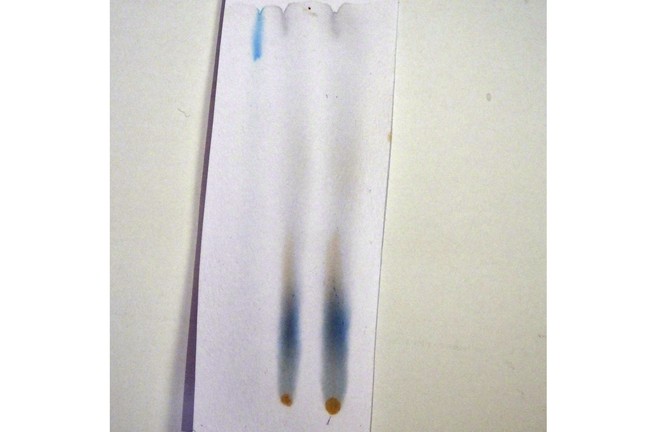
La separación de los componentes de colorante de alimentos utilizando papel secante y agua.© Stephen H. Ashworth
Experimento 4 - El cromatograma
En este experimento hemos de separar los componentes de las tintas o colorante de alimentos.
Para este experimento necesitarás:
- Los diferentes colores de los alimentos o las tintas de rotuladores u otras plumas (no bolígrafos)
- Agua
- Sal
- El papel secante u otro papel absorbente (aunque toalla de cocina es absorbente que no es adecuado para este experimento, ya que a menudo no es el mismo en todas partes)
- Cristal u otro frasco o recipiente transparente
Hacer una solución de aproximadamente 4 g de sal en aproximadamente 100 ml de agua. Tome el papel secante y cortar un rectángulo de unos 10 cm × 5 cm. Alrededor de 2 cm del fondo dibujan una línea de lápiz de luz.Utilice un palillo para poner un par de gotas de colorante de alimentos en la línea de lápiz de luz. Mantenga el lugar tan pequeño como sea posible.Ponga diferentes colores en diferentes lugares en la línea.
Ponga un poco de la solución de sal en el fondo de un recipiente de vidrio o de modo que es de aproximadamente 1 cm de profundidad. Hacer un cilindro del papel secante, que mantenga los bordes junto con clips o grapas, pero no se superpone al papel. Alternativamente suspender el papel de algo así como un lápiz sentado en la parte superior de la jarra.Coloque el papel en el bote que se ha preparado con los puntos en la parte inferior. Es muy importante para asegurar que el agua en la parte inferior no toca las manchas. El agua se elaborará el documento e ir más allá de los puntos, pero los puntos no debe estar bajo la superficie del agua.
La solución de sal hará que su camino hasta el papel y el color de los alimentos se tomarán con él. Si el color de los alimentos tiene más de un color en que estos deben ser separados en el papel.
La cromatografía es un procedimiento estándar para la separación y el examen de las mezclas. Hay muchas variaciones, pero todos se basan en el hecho de que las moléculas tienen diferentes interacciones con una sustancia que con otro. Vimos que el yodo prefiere disolver en aceite en vez de agua: es más soluble en aceite que en agua. En nuestro experimento cromatografía de las moléculas de color que son más solubles en agua son arrastrados fácilmente y viajar un largo camino. Por otro lado, aquellos que son menos solubles tienden a interactuar más con el papel y viajar más lentamente.
Saque el papel de la jarra antes de que el agua haya llegado a la cima.Usted ha producido un cromatograma. Comparte tu cromatograma con otros en el curso ...

Un limón en el árbol.© Stephen H. Ashworth
Ácidos y álcalis
Estamos probablemente ya está familiarizado con algunos ácidos. Las frutas cítricas contienen ácido cítrico, y el vinagre es una solución de ácido acético. Ambos tienen un sabor amargo característico. Hay también un ácido, ácido sulfúrico, en una batería de coche - pero no trate de averiguar si ese sabor agrio. Lo contrario de un ácido es un álcali (o una base): muchos materiales de limpieza, tales como pasta de dientes o sosa son alcalinas.
Si se mezcla un ácido con la cantidad correcta de álcali tenemos una solución que no es ni ácida ni alcalina: es neutro. A menudo es importante saber exactamente el grado de acidez o alcalinidad de una solución. Una manera de medir esto es utilizar un material que cambia de color en ácido o alikali. Muchos materiales de color son capaces de indicar el ácido (o alcalino) de concentración de esta manera. Cualquier cosa con esta propiedad se conoce como un indicador.
Hay un método de análisis conocido como titulación que se utiliza para medir exactamente la cantidad de ácido o álcali (base) se encuentra en una solución. En este método se mide la cantidad de una solución de concentración conocida de ácido (o base) que se requiere para contrarrestar exactamente una solución de concentración desconocida de álcali (o ácido). Un indicador puede ser utilizado para encontrar el punto en el que el ácido y el álcali (base) son exactamente equilibrada. Hay indicadores para otras sustancias también, no sólo para los ácidos y álcalis. Vamos a estar usando uno de estos la próxima semana para hacer un análisis.
Experimento 1 - Elaboración de indicadores
Para este experimento necesitarás:
- Contenedores para las soluciones tales como ollas limpias, yogur vacíos, vasos o similares
- Col roja y / o
- Té de la fruta y / o
- Jugo de remolacha y / o
- Polvo de la cúrcuma
- El alcohol, como espíritus quirúrgicas o vodka
- De sosa comercial (carbonato de sodio)
Indicador de col roja
Tome un poco de col roja, rallar finamente y hervir en un poco de agua durante unos minutos. La col roja rallada acabará gris y el agua debe ser un color púrpura oscuro. Alternativamente, lavar algunos col roja rallado o en puré en un poco de agua. Esto también va a producir una solución de color púrpura. Si su solución es un color púrpura muy oscuro debe añadirse al agua para diluir antes de su uso. Debe ser un color púrpura pálido antes de su uso. Tenga en cuenta también que esto no va a mantener muy bien y es mejor recién hecho antes de su uso.
Indicador de Té de la fruta
Verter agua hirviendo sobre una bolsa de té de frutas. Bayas rojas o negras funcionan mejor. Deje la bolsa en el agua caliente durante un rato.Deje que la solución se enfríe antes de usarlo. Una vez más usted puede encontrar que usted consigue mejores colores si se diluye la solución de color con un poco de agua adicional.
Indicador de Jugo de remolacha
Jugo de remolacha en ocasiones se puede comprar en un supermercado.En este caso no necesita ser diluida, mediante la adición de un poco de agua adicional, antes de su uso. Otra opción es tomar una remolacha, hervir con la piel y luego quitar la piel. La solución de color rojo que se obtiene de la ebullición y del jugo actuará como indicador.
Indicador de cúrcuma
El compuesto de color amarillo en la cúrcuma no se disuelve muy fácilmente en agua, pero que puede disolver fácilmente en un alcohol o en una solución alcalina tal como una solución de carbonato de sodio. Ponga un poco de cúrcuma en polvo en un recipiente que no desea volver a utilizar - que teñirá de plástico, superficies de trabajo, etc - y añade ya sea unos pocos ml de alcohol o una solución de sosa comercial. Si utiliza alcohol la solución seguirá siendo amarillo, con sosa se volverá de color rojo oscuro. La cúrcuma en polvo no se disuelve por lo que la solución de color debe ser vertido fuera muy cuidadosamente para separarlo del sólido (que es conocido como decantación). Alternativamente, podría ser filtrado.
Otros indicadores
Muchas otras sustancias coloreadas actúan como indicadores. Yo uso regularmente jugo de uva roja como indicador. En este caso, por supuesto, el jugo es ácido por lo que se utiliza mejor para detectar la presencia de un álcali (base) en cuyo caso se vuelve verde.

El uso de la química de los indicadores de cambiar a rojo en el "vino" blanco.© Stephen H. Ashworth
Experimento 2 - Uso de indicadores
Para este experimento necesitarás:
- Una de las soluciones indicadoras que hicimos en el experimento 1
- Vinagre
- De sosa comercial (carbonato de sodio)
- Otros materiales de uso doméstico, tales como - la pasta de dientes, el jugo de limón, lavando líquido.
Tome una de sus soluciones indicadoras y añadir un poco de vinagre.¿Cambia el color?
Tomar una muestra diferente y añadir un poco de carbonato de sodio (sosa). ¿Cambia el color? ¿Es un cambio de color diferente?
Si intenta diferentes indicadores se cambie el color diferente?
Utilice su indicador (s) para probar si otros materiales de uso doméstico son ácidos o álcalis. Si el cambio de color es similar a la que con vinagre tiene un ácido, si es similar a aquella con la soda de lavado, tiene un álcali (base). Si no hay cambio de color puede tener una solución neutra que no es ni ácida ni alcalina. Tenga en cuenta que puede que tenga que agregar más de algunos materiales que otros para ver un cambio de color.
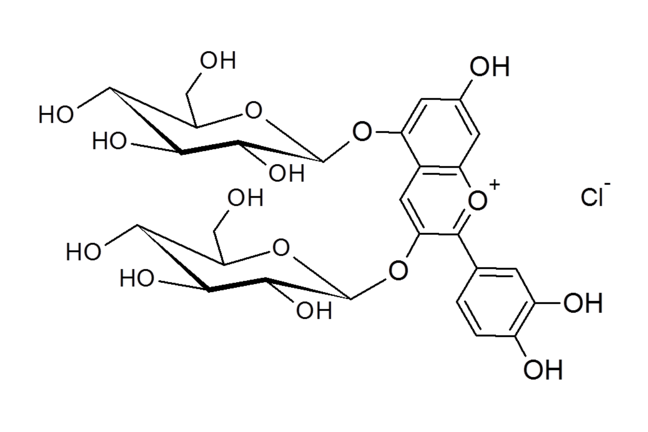
Una molécula que actúa como un indicador y es similar a los encontrados en la col roja y otras frutas rojas y bayas.© Stephen H. Asworth
Producción de colores
La molécula responsable del color de la col roja y muchas bayas de intensa coloración proviene de una familia de moléculas llamadas las antocianinas. Recuerde que cada esquina en uno de estos diagramas moleculares representa un átomo de carbono que puede estar unido a uno o más átomos de hidrógeno. (Estos se pueden activar y desactivar en la molécula interactiva que se puede encontrar aquí .)
Hay dos partes distintas de la molécula en la imagen de arriba. Hay los grupos de la izquierda que son azúcares, como la glucosa y la sacarosa.De hecho los que se muestran aquí son una forma de glucosa. Estos grupos de azúcar hacen las moléculas de antocianinas. Sin esos azúcares tendríamos antocianidinas, como cianidina en sí se muestra a continuación como cloruro de cianidina.

Esta molécula tiene una gran cantidad de átomos de oxígeno (O) conectados a átomos de hidrógeno (H) para formar el "grupo OH" o "grupo hidroxilo". Estos átomos de hidrógeno permiten una molécula como este para actuar como un ácido, por lo que si se aumenta el pH de la solución de la molécula anterior (hacen que sea menos ácida) estos grupos se empiezan a perder (con carga positiva) protones dejando una carga negativa detrás. El primer paso es hacer que la molécula neutra en general y su estructura se puede representar como el siguiente diagrama.La diferencia importante es que las líneas dobles (dobles enlaces) que se han elaborado en comparación con las líneas individuales (bonos individuales).

Este cambio en la estructura significa que el color de la luz que absorbe la molécula también cambiará. El cambio que se somete a la molécula está cubierto con más detalle en el video en el siguiente paso.

Indicador de té de bayas rojas en la leche de magnesia© Stephen H. Ashworth
Experimento 3 - Un álcali eterna?
Para este experimento necesitarás:
- Un indicador preparado como en el experimento 1
- La leche de magnesia (no utilizar la crema de magnesia)
- Vinagre de alcohol
- Agua
Añadir un poco de leche de magnesia al agua fría y mezclar bien. La mezcla debe parecer lechosa como la leche de magnesia tiene una muy baja solubilidad en agua. Agregar suficiente indicador para mostrar un color claro y mezclar bien. ¿Qué se observa? El indicador está mostrando la acidez (o alcalinidad) de la solución. ¿Es lo mismo que el agua pura?¿Qué ha provocado este cambio?
Añadir una cucharada de vinagre. ¿Hay un cambio de color?
Agitar bien la solución y anota tus observaciones. Añadir un poco más de vinagre. ¿Hay un cambio de color?
¿Por qué no compartir sus resultados y discutir lo que usted piensa que podría estar sucediendo?
Echa un vistazo a Wikipedia para más información sobre la leche de magnesia (también conocido como el hidróxido de magnesio). Para algunas ideas sobre lo que está sucediendo es posible encontrar la cocina Química página útil.
Experimento 4 - Un indicador incoloro
Para este experimento necesitarás:
- Harina de maíz (también conocido como el almidón de maíz o bajo un nombre de marca como Maizena)
- Hervir el agua
- Agua fría
- Tintura de yodo
- Una taza y dos copas (o envases de yogur)
Ponga una pequeña cantidad de harina de maíz - un cuarto de cucharadita de té es más que suficiente - en una taza y añadir media taza de agua hirviendo. Revuelva bien. La mezcla debe ser un poco nublado, pero sin color. Esta es la solución de almidón.
Ponga la misma cantidad de agua fría en cada uno de sus contenedores.
Añadir diez gotas de tintura de yodo para cada uno. Esta es la solución de yodo.
Transferir un poco - comenzar con una cucharadita - de la solución de almidón a una de sus soluciones de yodo y comparar los dos.

Harina de maíz quemado (oxidado) para crear una gran llama de color naranja.© Stephen H. Ashworth
La oxidación y la reducción
La oxidación fue originalmente el término que se utiliza para combinar una sustancia con el oxígeno. Esto es lo que sucede cuando quemamos combustible. Tomemos una vela como un ejemplo. La reacción aquí es el vapor de cera se combina con el oxígeno para producir agua, dióxido de carbono y energía. El último de ellos (energía) se observa en forma de calor y luz. En este caso, el combustible se ha oxidado - combinado con el oxígeno.
En estos días la oxidación término tiene un significado más amplio: significa la pérdida de electrones. Cuando hay algo en una reacción que puede ser identificado como oxidarse, y perder así los electrones, también debe haber algo que se puede obtener de ellos. Una sustancia que acepta electrones de esta forma se dice que está reducida. Muchas reacciones químicas se basan en la transferencia de electrones de esta manera. Como no es tanto una RED ucción y un OX lidación estos se conocen como reacciones redox.
Un ejemplo es la reacción del sodio con cloro. Podemos reaccionar un trozo de metal de sodio con un poco de gas cloro y el producto será de cloruro de sodio, que sabemos que la sal es tan común. En este proceso, el átomo de cloro gana un electrón del átomo de sodio. La pérdida del electrón significa que el átomo de sodio se oxida y se convierte en un ion de sodio positivo, mientras que el átomo de cloro gana un electrón y se convierte en un ion cloruro. La carga positiva en el átomo de sodio equilibra la carga negativa del ion cloruro así que todo es eléctricamente neutro y los dos átomos con carga eléctrica, lo que nos referimos como iones, son fuertemente atraídos el uno al otro.
El símbolo para el sodio es Na y nos indique que está cargado positivamente mediante la adición de un pequeño "+" como un exponente: Na + . Del mismo modo indicamos que el átomo de cloro (Cl) está cargado negativamente, añadiendo un pequeño "-" como un exponente: Cl - . Si hablamos de sal, sin embargo, el balance de cargas positivas y negativas por lo que se anota NaCl.
Las reacciones redox en coche muchos procesos que nos rodea. Baterías se basan en reacciones redox, pero en lugar de los electrones se transfieren directamente a otro átomo o molécula que se ven obligados a fluir alrededor de un circuito. Muchos procesos biológicos, como la fotosíntesis, se basan en este tipo de reacciones de transferencia de electrones donde las moléculas repetidas ocasiones se convierten reducida (ganar un electrón) y oxidado (pierde el electrón de nuevo) para almacenar y liberar energía.
Esto se puede utilizar junto con el sistema de yodo de almidón que nos encontramos en el último tramo para medir la cantidad de vitamina C en un material. No sólo es la vitamina C, una vitamina, pero es un anti-oxidante. Para un químico un anti-oxidante es una sustancia que puede actuar para reducir otras sustancias: un agente reductor.
La vitamina C
Todos necesitamos la vitamina C para mantenerse sano: es un nutriente vital. Sin suficiente vitamina C los humanos desarrollan una enfermedad conocida como escorbuto. Junto con algunos otros animales, tenemos que comer alimentos que contienen vitamina C ya que no podemos sintetizar en nuestros cuerpos. El escorbuto solía ser una enfermedad mortal para los marineros y soldados, que a menudo tenían que pasar largos períodos sin frutas y hortalizas frescas. Uno de los síntomas del escorbuto es encías esponjosas y sangrantes.Esto ocurre porque la vitamina C es necesaria para que el cuerpo produzca colágeno: un componente importante del tejido conectivo.La Armada encontró que el jugo de limón añade el ron y el agua (grog) marineros mantenerse saludable y es por eso que el Inglés se refiere a veces como Limeys.
La vitamina C es un término para un número de moléculas que todos tienen la misma acción biológica. El que está más estrechamente relacionada con la vitamina C es ácido ascórbico se muestra a continuación. Mira la molécula con más detalle aquí .

Vamos a utilizar una propiedad del ácido ascórbico que significa que puede actuar como un agente reductor. A su vez él mismo se oxida. El ácido ascórbico da fácilmente a sus electrones a un agente oxidante suficientemente poderoso. La pérdida de estos electrones reduce el agente oxidante y el agente reductor se oxida. El agente oxidante que vamos a utilizar es el yodo. El yodo, que comienza eléctricamente neutro, se convertirá en yoduro, y el ácido ascórbico se convertirá en ácido dehidroascórbico, la cual se puede ver a continuación y examinar con más detalle .


La primera gota de yodo en la solución después de toda la vitamina C se ha agotado.© Stephen H. Ashworth
Calibración de los reactantes
Vamos a utilizar el complejo de yodo con el almidón que nos reunimos la semana pasada como nuestro indicador. La vitamina C se utiliza para reducir el yodo, que se convertirá en yoduro (I - ). Como yoduro no hace que el color azul-negro en presencia de almidón de una vez todo el yodo se ha convertido en yoduro el color azul-negro desaparecerá.
A continuación se muestra la reacción entre el ácido ascórbico y el yodo.

Podemos ver que se necesita una molécula de ácido ascórbico para reducir una molécula de yodo (I 2 ). En el proceso el ácido ascórbico se convierte en ácido deshidroascórbico y el yodo se convierte en yoduro. Si hacemos una solución que contiene vitamina C y el almidón y luego añadimos yodo, llegará un punto en que toda la vitamina C se ha agotado y vamos a ver un color azul-negro que no desaparece al agitar. Si sabemos cuánto yodo hemos añadido, entonces podemos decir cuánta vitamina C estaba en la solución original.
Para ello vamos a convertir el proceso en su cabeza. Al hacer una solución de vitamina C, usando una tableta de vitamina C solubles, se conoce la concentración. La cantidad de yodo que se requiere para observar un color estable en esta solución se puede medir.
Por ejemplo, la disolución de una tableta con 1,000 mg (1 g) de la vitamina C en un litro de agua da una solución con una concentración de vitamina C de 1 g por litro. Si 10 ml de esta solución se utiliza para una medición entonces no es 10 mg de vitamina C en la solución. Si se añade un poco de almidón y tintura de yodo se añade gota a gota podemos encontrar que 80 gotas de yodo tienen que ser añadidos antes de la solución se vuelve azul-negro (y el color no desaparece cuando se sirred la solución).Así que 10 mg de vitamina C han convertido 80 gotas de yodo. Si luego probar un desconocido y que tenga que añadir 8 gotas de la misma solución de yodo antes de que se forma un color estable sabemos que no fue de 1 mg de vitamina C en la solución.
Este es el experimento que vamos a tratar ahora. Podría ser interesante para visitar la Real Sociedad de Química sitio web en el enlace relacionado para que pueda registrar sus resultados como parte de la 2013 experimento global.

La disolución de la tableta que se utiliza para calibrar nuestro equipo y solución de yodo.© Stephen H. Ashworth
Experimento 1 - Calibración
Para este experimento necesitarás:
- Harina de maíz (almidón de maíz, almidón de maíz o equivalente)
- Tintura de yodo
- Tableta de vitamina C Soluble
- Pipeta o gotero
- Hervir el agua
- Dispositivo de medición (por ejemplo, una jeringa, o un pequeño recipiente que puede ser llenado de manera fiable al mismo punto)
- Cup (para hervir agua para hacer que el indicador)
- Una gama de otros contenedores pequeños para hacer mediciones en
Ponga alrededor de una cuarta parte de una cucharadita de harina de maíz en una taza. Añadir media taza de agua hirviendo. La mezcla debe ser nasal después, no una pasta. Esta es tu indicador de almidón. Prueba de ello se añaden algunas gotas de indicador de unas gotas de tintura de yodo disuelto en agua, como lo hicimos en la última cuota.
Tome nota de la cantidad de vitamina C se encuentra en una de las tabletas y disolver esta en un litro (1 L) de agua. Tomar una pequeña (conocida) cantidad - 50 ml por ejemplo - de la solución de vitamina C y agregar cinco gotas de indicador de almidón.
Para su mezcla de vitamina C y el indicador de almidón, añadir gotas de yodo, contando cuidadosamente las gotas, hasta que la solución se desarrolla un color azul-negro que no desaparece al agitar. Para obtener un número más preciso es posible repetir el experimento y tomar el promedio de una serie de lecturas.
Ahora sabemos que el número de gotas de yodo que reacciona con la vitamina C en nuestra volumen de la solución. Si ese volumen es un número conocido de mililitros que podemos trabajar cuántas gotas de yodo requerimos por miligramo de vitamina C. Si el volumen es desconocido, pero reproducible, podemos trabajar la cantidad de vitamina C en lo desconocido utilizando la relación de gotas. * Asegúrese de que el mismo equipo * se utiliza para hacer el siguiente paso (el mismo gotero, etc.)

Cuatro etapas en el análisis de vitamina C utilizando yodo y almidón.© Stephen H. Ashworth
Experimento 2 - Análisis de un desconocido
Para este experimento necesitarás:
- Tintura de yodo calibrada.
- Fruta o jugo de vegetales (lo ideal es algo que no está muy coloreada).
- La misma pipeta o el ojo gotero utilizado para calibrar la solución de yodo.
- Dispositivo (por ejemplo, una jeringa, o un pequeño recipiente que puede ser llenado de manera fiable al mismo punto) de medición.
- Indicador de almidón (preparada en el experimento 1).
Medir una cantidad conocida de su jugo desconocido. Utilice el mismo método que utilizó para la calibración. Añadir un poco de indicador de almidón y contar el número de gotas de yodo requeridos antes de que se formó un color estable. Es probable que sea mucho menos gotas este tiempo!
Si fueron capaces de calibrar el número de gotas por miligramo de vitamina C ahora se puede calcular el número de miligramos de vitamina C en una cantidad conocida de jugo. Si su respuesta fue algo así como 3.4 mg en cada 50 ml, entonces podemos decir que hay (1000/50) x 5,3 mg por litro de zumo. En este caso, el desconocido tiene 106 mg de vitamina C por litro de jugo.
Si ha medido a cabo la solución de calibración y el desconocido en la misma olla, pero usted no sabe el volumen que hacemos el cálculo de forma ligeramente diferente. Digamos, por ejemplo, la concentración conocida de la vitamina C fue 1,000 mg por litro. Supongamos también que se necesitaban 120 gotas de yodo para producir un color estable en una medida de la solución de calibración, pero sólo se requirieron 8 gotas por lo desconocido. Trabajamos a cabo la concentración del desconocido multiplicando la relación o el número de gotas por la concentración de la solución de calibración (8/120) x 1000 mg. En este caso, el desconocido tiene 66 mg de vitamina C por litro de jugo.

Cuatro etapas en el análisis de vitamina C utilizando yodo y almidón.© Stephen H. Ashworth
Experimento 2 - Análisis de un desconocido
Para este experimento necesitarás:
- Tintura de yodo calibrada.
- Fruta o jugo de vegetales (lo ideal es algo que no está muy coloreada).
- La misma pipeta o el ojo gotero utilizado para calibrar la solución de yodo.
- Dispositivo (por ejemplo, una jeringa, o un pequeño recipiente que puede ser llenado de manera fiable al mismo punto) de medición.
- Indicador de almidón (preparada en el experimento 1).
Medir una cantidad conocida de su jugo desconocido. Utilice el mismo método que utilizó para la calibración. Añadir un poco de indicador de almidón y contar el número de gotas de yodo requeridos antes de que se formó un color estable. Es probable que sea mucho menos gotas este tiempo!
Si fueron capaces de calibrar el número de gotas por miligramo de vitamina C ahora se puede calcular el número de miligramos de vitamina C en una cantidad conocida de jugo. Si su respuesta fue algo así como 3.4 mg en cada 50 ml, entonces podemos decir que hay (1000/50) x 5,3 mg por litro de zumo. En este caso, el desconocido tiene 106 mg de vitamina C por litro de jugo.
Si ha medido a cabo la solución de calibración y el desconocido en la misma olla, pero usted no sabe el volumen que hacemos el cálculo de forma ligeramente diferente. Digamos, por ejemplo, la concentración conocida de la vitamina C fue 1,000 mg por litro. Supongamos también que se necesitaban 120 gotas de yodo para producir un color estable en una medida de la solución de calibración, pero sólo se requirieron 8 gotas por lo desconocido. Trabajamos a cabo la concentración del desconocido multiplicando la relación o el número de gotas por la concentración de la solución de calibración (8/120) x 1000 mg. En este caso, el desconocido tiene 66 mg de vitamina C por litro de jugo.

La catálisis demostrando autor.© Stephen H. Ashworth
¿Qué es un catalizador?
Lo que realmente sucede en una reacción química? Las moléculas deben chocar entre sí para reaccionar. De hecho, no sólo tienen que chocar entre sí que tienen que estar en la posición correcta y el golpe debe tener más de una energía mínima. En la primera semana, se encontró que el aumento de la temperatura de las moléculas les da más energía y, como resultado, moverse más rápidamente. Esto significa que las moléculas chocan juntos con más frecuencia y con más energía. Si se enfrentan a la manera correcta más de ellos tiene suficiente energía para reaccionar, por lo que el producto de la reacción se forma más rápido. Es por eso que a menudo es suficiente para elevar la temperatura para que una reacción sea más rápido, o por el contrario enfriarlo para hacer que vaya más despacio.
Podemos pensar que nuestra reacción como un paisaje. El camino desde las moléculas que están reaccionando (los reactivos) a los productos va sobre una colina. En el otro lado de la colina, donde los productos se han formado, el fondo del valle se encuentra a una altitud más baja que donde los reactivos son. Podemos pensar en la altura como la cantidad de energía que las moléculas tienen. Si tienen suficiente para superar la parte superior y por el otro lado, entonces ocurre la reacción. Por supuesto, los reactantes pueden chocar con la energía suficiente para superar la colina, pero que podría no estar en la posición correcta con el fin de reaccionar.
Podemos ver un "cerro de energía" como esta en la foto de abajo. Los reactivos están en el lado de la izquierda y si tienen suficiente energía (y la orientación a la derecha) se puede obtener en la colina, al otro lado. En la parte derecha de la colina que se han formado productos. En este caso los productos son más bajos en energía así, como resultado, la diferencia de la energía se emite. A menudo nos experimentar esta forma de calor, de nuestra vela encendida, por ejemplo. Cualquier reactivos que no reaccionan se mantienen en el lado izquierdo de la colina.

El calentamiento de los reactantes hasta significa que en cualquier momento una mayor proporción de ellos tienen la energía suficiente para hacer sobre los productos de la montaña y ayude. Es por eso que la reacción va más rápido cuando nos calentamos. La energía necesaria para superar la colina se conoce como la energía de activación.
Afortunadamente, las moléculas de calefacción para arriba no es la única manera de conseguir una reacción a ir más rápido. Hay muchas moléculas y sustancias que son capaces de acelerar una reacción química, pero no se consumen en la reacción global. Estas sustancias se conocen como catalizadores. El más familiar podría ser el catalizador que se encuentra en la mayoría de los vehículos de gasolina con motor.
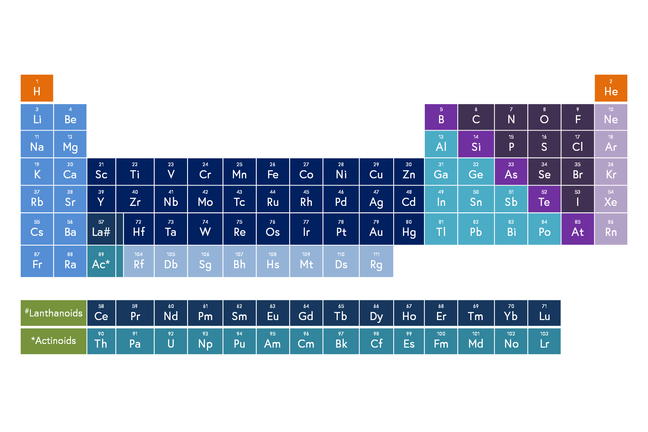
La tabla periódica
¿Qué hace un catalizador?
Al calentar nuestras moléculas podemos asegurar que una mayor fracción de ellos tienen la energía necesaria para superar la cuesta de energía que conduce a la reacción cuando chocan. Otra forma de hacer lo mismo es reducir la altura de la colina. La situación con una lata de catalizador es más probable que sea como la que se muestra en la imagen siguiente.

El catalizador está permitiendo a las moléculas de reaccionar sin tener que tener la energía para superar la gran colina (en gris) para más de las colisiones tienen la energía suficiente para provocar una reacción.
Muchos metales son buenos catalizadores, especialmente los que están en el medio de la tabla periódica. Estos son los llamados metales de transición (de color azul oscuro en la imagen principal). Puede haber metales tales como platino (Pt), paladio (Pd), y el rodio (Rh) en un convertidor catalítico. Los metales están finamente divididos y apoyados en un panal de cerámica. Otros metales, tales como hierro (Fe), cobre (Cu) y níquel (Ni) también pueden actuar como catalizadores para reacciones específicas.
La razón de esto es todos estos metales puede fácilmente tomar parte en las reacciones redox. Los metales de transición pueden tanto tomar y ceder electrones muy fácilmente. Esto puede reducir la energía "colina" entre los reactivos y productos. De hecho la primera fuego más ligero se basa en un catalizador de metal tal. Un chorro de hidrógeno a partir de la reacción de zinc y ácido se dirige sobre una esponja de platino y el calor desprendido de la reacción es suficiente para encender el hidrógeno para formar agua. Por lo general, hidrógeno necesitaría una chispa o una llama para encender, pero en este caso que la energía de calor viene desde el catalizador permitiendo de hidrógeno y oxígeno para combinar, que se calienta el metal. En los días previos a los partidos del fuego Döbereiner se utilizó más ligero para encender velas y fuegos.
El siguiente paso de vídeo muestra un experimento que utiliza el cobre para catalizar una reacción.
Experimento 1 - Catálisis usando cobre
Este video muestra un experimento en el que se utiliza el cobre para catalizar la reacción de vapor de la acetona con el oxígeno en el aire.Este es un video como el producto de la reacción, de cetena, es unextremadamente de gas irritante, por lo que la reacción debe llevarse a cabo en áreas bien ventiladas. Además, necesita el cobre para calentar inicialmente así que uno debe tener mucho cuidado de no encender la acetona inflamable.
La reacción se puede llevar a cabo de forma segura en su casa si no se toman las precauciones adecuadas.
- La zona debe estar bien ventilada para evitar la acumulación de los gases de cetena.
- No permita que la reacción continúe durante mucho tiempo. Esto evitará que las altas concentraciones de cetena edificación.
- La fuente de calor utilizado para calentar el cobre no se debe permitir que encender el vapor de acetona altamente inflamable.
En caso de alguna duda , por favor vea el video en lugar de hacer la reacción de uno mismo.
Experimento 1 - Catálisis usando cobre
Este video muestra un experimento en el que se utiliza el cobre para catalizar la reacción de vapor de la acetona con el oxígeno en el aire.Este es un video como el producto de la reacción, de cetena, es unextremadamente de gas irritante, por lo que la reacción debe llevarse a cabo en áreas bien ventiladas. Además, necesita el cobre para calentar inicialmente así que uno debe tener mucho cuidado de no encender la acetona inflamable.
La reacción se puede llevar a cabo de forma segura en su casa si no se toman las precauciones adecuadas.
- La zona debe estar bien ventilada para evitar la acumulación de los gases de cetena.
- No permita que la reacción continúe durante mucho tiempo. Esto evitará que las altas concentraciones de cetena edificación.
- La fuente de calor utilizado para calentar el cobre no se debe permitir que encender el vapor de acetona altamente inflamable.
En caso de alguna duda , por favor vea el video en lugar de hacer la reacción de uno mismo.
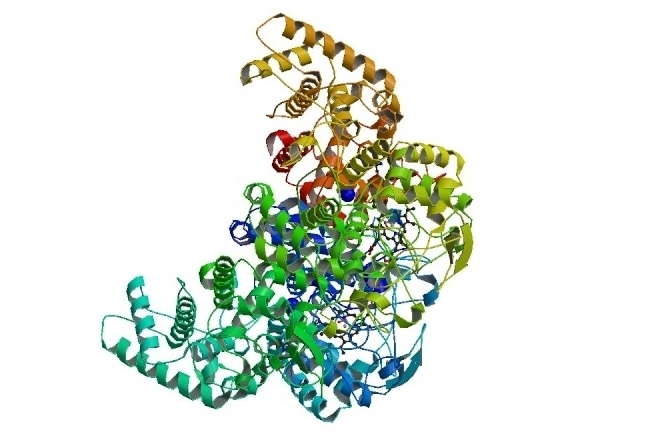
Un catalizador biológico de cerca - las cintas ayudan a mostrar la estructura de la molécula.
Catálisis en biología
Al leer esto, hay miles de reacciones químicas que van en sólo para mantenerse con vida. Todos ellos pasan a la temperatura corporal. De hecho la mayoría de ellos normalmente sería tan lenta a esta temperatura que sería difícil de detectar que estaban sucediendo en absoluto. Afortunadamente para nosotros los sistemas biológicos han desarrollado una manera de acelerar muchas reacciones. Las enzimas son los catalizadores que utilizan sistemas biológicos.
Las enzimas son generalmente grandes moléculas de proteínas que realizan trabajos muy específicos. Este enlace muestra una imagen de una enzima. De hecho, esta enzima se encuentra en la saliva y ayuda a picaramilosa , una molécula que conocimos la última vez. La amilosa es una larga cadena de unidades de glucosa, al igual que el almidón y amilasa chuletas (y almidón) hacia arriba. La próxima vez que usted tiene un pedazo de pan tardar un poco en la boca y masticar bien. Si puedes mantener en la boca durante un tiempo la acción de amilosa en su saliva debe hacer que se inicie al gusto dulce.
Las enzimas son muy específicas y por lo general sólo funcionan con una sustancia química, a diferencia de los catalizadores de metales de las que hablamos antes. Esto es porque las enzimas aceleran las reacciones en dos formas diferentes. En primer lugar, al igual que todos los catalizadores, que reducen la energía requerida para someterse a reacción.Segundo que son capaces de mantener las moléculas en exactamente la orientación correcta para que puedan reaccionar. No sólo no tienen que "subir" un gran "colina de energía" como ellos no tienen que depender de una colisión en tan sólo la orientación correcta.
Mientras que la amilasa es romper el almidón que nos permita absorber la glucosa, otras enzimas están ocupados construyendo proteínas, por lo que otras enzimas y almacenar energía. Otra función importante de las enzimas es descomponer las sustancias tóxicas. Con sólo respirar producimos peróxido de hidrógeno, H 2 O 2 . El peróxido de hidrógeno es tóxico por lo que los niveles no se debe permitir que se acumulan en nuestros cuerpos. Para evitar que los niveles de la construcción de nuestro cuerpo tienen una enzima para romper hacia abajo con rapidez: catalasa peroxidasa.
Un tipo de catalasa peroxidasa se muestra en esta imagen interactiva.Usted se dará cuenta de que la imagen tiene cintas que lo atraviesa. Esto ayuda a mostrar la estructura de la proteína, que es una larga cadena de aminoácidos que se pliega en la complicada estructura que se ve aquí.Pulsando "Ball and Stick" que puede desactivar las cintas y ver todos los átomos, como hemos visto antes, "cintas" muestra tanto los átomos y la estructura de la cinta, pero la "historieta" apaga los átomos individuales dejando sólo el estructura general. A menudo, la cinta o el cuadro de la historieta es muy útil cuando se trata de este tipo de moléculas grandes.(Grandes moléculas como éste se conocen como macromoléculas.)
Si nos fijamos en la opinión de la cinta de dibujos animados o usted debería ser capaz de distinguir dos tipos diferentes de estructura que son comunes en las proteínas. Hay estructuras helicoidales (primaveral), que se conocen como una hélice α (mostrado en rosa y morado) y zonas planas (en amarillo) que se conoce como β-hojas. El resto de la cadena de aminoácidos que componen la proteína se muestra en blanco como estas áreas forman ni α-hélices ni β-hojas.

Una espuma de oxígeno se produce a partir de la enzima en peróxido de hidrógeno de descomposición de levadura.© Stephen H. Ashworth
Experimento 2 - Catálisis en biología
Para este experimento necesitarás:
- Una papa
- Levadura (secas o frescas)
- El peróxido de hidrógeno (disponible en diferentes concentraciones - max 40% - en las farmacias)
- Una pequeña cantidad de agua
- Unas pocas gotas de detergente líquido
- Un vaso, jarra, olla de yogur u otro recipiente
- Gafas de patillas
Tenga en cuenta que el peróxido de hidrógeno es un blanqueador y se altera el color de cualquier material que entre en contacto con (incluso sus manos). Si bien siempre es una buena idea usar gafas de seguridad cuando se hace la química es un experimento, en función de cómo se lleva a cabo, en donde es muy recomendable.
Mezclar la levadura y el agua y dejar reposar durante 5 - 10 min. Debe haber suficiente agua que la mezcla se vierte fácilmente. Mientras espera cortar una pieza fresca de la patata. Ponga un poco de solución de peróxido de hidrógeno en un recipiente y añadir la pieza recién cortada de la papa. ¿Qué se observa?
Ponga un poco más de peróxido de hidrógeno en otro recipiente y añadir unas gotas de detergente líquido. Las enzimas de la levadura deben convertir el peróxido de hidrógeno en agua y oxígeno. Como el oxígeno es un gas líquido de lavado hasta hará una espuma que captura las burbujas del gas, por lo que es más fácil ver lo que está sucediendo. Añadir la levadura a la mezcla de peróxido de hidrógeno y el líquido de lavado y observe lo que sucede
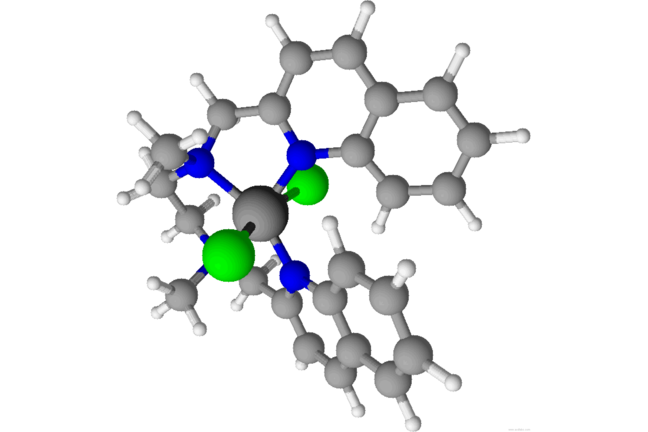
Un ejemplo de un catalizador a base de hierro que puede ayudar a hacer plásticos© Stephen H. Ashworth
Reflexiones finales sobre la catálisis
Los catalizadores se utilizan en muchas maneras. Hay catalizadores específicos y los no específicos. Hay aquellos que están en el mismo estado (por lo general la solución) como las sustancias con las que trabajan y los que están en un estado diferente. cada uno de ellos tienen sus ventajas y desventajas.
Ya hemos mencionado los metales preciosos que se encuentran en nuestros coches y que ayudan a limpiar los gases de escape. Los catalizadores en este caso no son específicos, ya que pueden reaccionar con un número de diferentes gases, y que están en un estado diferente a los reactivos que están catalizar. Por lo tanto el catalizador se conoce como un catalizador heterogéneo .
La molécula de la foto de arriba puede ser utilizado para hacer plásticos.Es capaz de reaccionar con una pequeña gama de moléculas y tendría que ser disuelto en la solución con las moléculas se catalizar. Esto se conoce como un catalizador homogéneo. Esto es simplemente un ejemplo de uno de los muchos catalizadores que se utilizan rutinariamente en la industria para la fabricación de plásticos. La industria química se basa en catalizadores para ahorrar energía en la fabricación de caucho para neumáticos, los plásticos que se utilizan para fabricar botellas, plexiglás para las ventanas y todos los otros plásticos que utilizamos a diario. Es decir, antes incluso de considerar lo que podría ser utilizado para ayudar a la fabricación de otros productos químicos, como los medicamentos para los medicamentos.
Algunos de los catalizadores que utilizamos habitualmente no son sintetizados por los químicos sin embargo. Detergentes biológicos contienen enzimas que se utilizan para digerir manchas de grasa. Por lo general, el lavado se realiza a temperaturas superiores a la temperatura del cuerpo y las enzimas sólo tienen un rango limitado de temperaturas en el que trabajan de manera eficiente, por lo que las enzimas utilizadas en los detergentes son probables haber sido cosechado de organismos adaptados para la vida en las aguas termales (como los de Yellowstone Parque Nacional. detergentes biológicos pueden contener una o más de cuatro enzimas diferentes. Una amilasa para digerir el almidón, unacelulasa para digerir la celulosa, una proteasa para digerir proteínas y unalipasa para digerir las grasas.
Es interesante comparar los catalizadores artificiales como el de la foto de arriba con los biológicos. El principio de acción es la misma en ambos, pero las estructuras voluminosas de las enzimas tienden a oscurecer un átomo de metal u otro centro reactivo muy similar a nuestro uno hecho por el hombre. No sólo las enzimas tienden a adaptarse a las moléculas que están reaccionando juntos a menudo cambian de forma para liberar el producto terminado.
compartir el saber es lo mejor del mundo
GRACIAS AL PROFESOR
KITCHEN CHEMISTRY
UNIVERSITY OF EAST ANGLIA
por abrirme una ventana a la química de una manera sencilla
"todo niño busca un gran profesor, para abrir una pequeña ventana, que lo lleve a un nuevo mundo no tan desconocido " juan camilo gomez 5 de mayo de 2014
